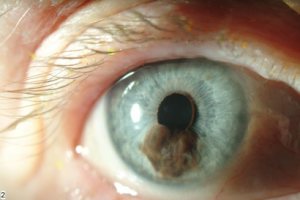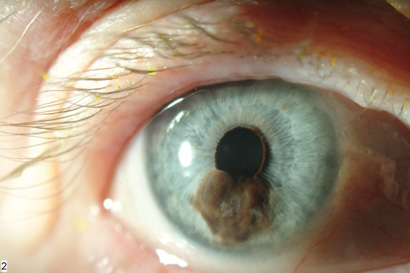
מלנומה ממאירה של הקשתית נדירה מאוד בהשוואה למלנומה של הענביה האחורית ומהווה כ 5% מכלל המלנומות הממאירות של הענביה. מלנומה זו מופיעה בגיל צעיר יותר מאשר מלנומה ממאירה של הענביה כשהגיל הממוצע הוא העשור החמישי לחיים ובשכיחות רבה יותר בבהירי עור בעלי עיניים בהירות כאשר המרכיב המיני אינו בעל חשיבות. המיקום השכיח להופעת המלנומה הינו החלק התחתון של הקשתית, כאשר קוטרה המינימלי הוא 3 מ"מ ועוביה המינימלי 1 מ"מ. השינויים הממאירים מתבטאים בשינוי צבע הקשתית, שינוי גודל, עיוות האישון, התפתחות כלי-דם חדשים, קטרקט, גלאוקומה שניונית והיפמה. מבחינה היסטולוגית רוב המלנומות הממאירות של הקשתית הן בדרגת ממאירות נמוכה יחסית, כאשר רובן מורכבות מתאי כישור. גורמי הסיכון להתפתחות גרורות במלנומה ממאירה של הקשתית הינם גיל מבוגר, התפשטות הגידול מחוץ לעין, מעורבות שורש הקשתית ועליית הלחץ התוך-עיני.
הפרוגנוזה במטופלי מלנומה ממאירה של הקשתית טובה ושיעור התמותה בקרב המטופלים נמוך יחסית לעומת מלנומה ממאירה של הענביה אחורית. עם ההבנה הקלינית הרחבה יותר של מחלה זו הטיפול הפך להיות שמרני ולכן הגישה הקלינית לגידול החשוד כמלנומה מתחילה בבדיקה תקופתית קפדנית של הסגמנט הקדמי. לאחרונה פורסמו מחקרים חדשים על בדיקת אולטרא סאונד מדויקת יותר מהאולטרא סאונד הקונבנציונלי הנקראת Ultrasound biomicroscopy(UBM). במידה והשאת מוגבלת לקשתית מבצעים ניתוח לכריתת הקשתית (Iridectomy), במידה וגם זווית הלשכה הקדמית מעורבת מבצעים Iridotrabeculectomy. Iridocyclectomy מתבצע כאשר גוף העטרה מעורב. במקרים בהם המלנומה מכסה יותר ממחצית הקשתית וזווית הלשכה הקדמית מעורבת עם עדות לעלית הלחץ התוך- עיני שאינו ניתן לשליטה, יש לשקול עקירת העין. לאחרונה פותחה שיטה חדשה לטיפול הנקראת ברכיתרפיה (Brachytherapy) באמצעות לוחיות רדיואקטיביות (radioactive plaques).
Jensen [3] מצא ש 97% מכלל מקרי המלנומה של הענביה כוללים בתוכם את הדמית וגוף העטרה ורק 3% כללו את הקשתית. מחקרים אחרים אשרו את שכיחותה הנמוכה של מלנומה ממאירה של הקשתית [4-5], גם במחקר שערכו Shield`s וחב' [1] על 8800 מטופלי מלנומה ממאירה של הענביה, נמצא שב 98% מכלל המקרים הגידול נתגלה בדמית או בגוף העטרה ורק ב 2% נתגלה הגידול בקשתית.
שכיחות המחלה מופיעה בגיל צעיר יותר מאשר המלנומה הממאירה של הענביה האחורית כשהגיל הממוצע הוא העשור החמישי לחיים [1,6,7], כשאין הבדל בין המינים [1,6,8]. המחלה מופיעה בבהירי עור ונדירה מאוד בבעלי עור כהה [2,9].
מאפיינים קליניים
במחקר שערכוShield וחב' [1] על 169 מטופלים הסובלים ממלנומה ממאירה של הקשתית, דווח שהמלנומה פגעה במידה שווה בשתי העיניים כשברוב המקרים צבעה של הקשתית כחול. קוטרו הממוצע של הגידול 6 מ"מ ועוביו הממוצע 2 מ"מ, צבעו הדומיננטי חום, צורתו נודולרית ומשטח הגידול הוא אי-רגולרי. לרוב מרכז הגידול ממוקם במחצית התחתונה של הקשתית [4,7,8], אך ישנם מקרים בהם המלנומה מפוזרת בצורה שווה בכל הקשתית.
המלנומה מופיעה בחלקה המרכזי של הקשתית ב 62% מהמקרים, ב 14% בשורש הקשתית, ב 4% בזוית הלשכה הקדמית וב 18% מהמקרים הגידולים מפוזרים בצורה הומוגנית בכל חלקי הקשתית [1].
כאשר מסווגים את מיקום הגידול בין חלקה הקדמי של הקשתית לחלקה האחורי של הקשתית נמצא שמרבית מהגידולים בחלקה הקדמית של הקשתית ימצאו באזור האישון ובאזור האמצעי, ואילו בזוית הלשכה הקדמית לא ימצא גידול אחד. בחלקה האחורי של הקשתית רוב הגידולים ימצאו בזוית הלשכה האחורית ובשורש הקשתית, ואילו באזור האישון לא ימצא גידול אחד [1]. התפשטות הגידול מחוץ לעין נמצאה במקרים מועטים, אך בכל המקרים הללו שורש הקשתית וזווית הלשכה הקדמית היו מעורבים.
במלנומה ממאירה של הקשתית הלחץ התוך עיני הממוצע הוא בד"כ mmhg 20, כאשר בשליש מהמקרים הלחץ התוך עיני מעל ל mmhg 23 וב 15% מהמקרים הלחץ התוך עיני הוא מעל mmhg 30 [1].
השינויים הממאירים יכולים להתבטא במס' סממנים: שינוי צבע, גודל ועיוות האישון, ליקוי בפיגמנט הקשתית, גלאוקומה שניונית, קטרקט, סובלוקציה של העדשה, דימום זגוגי [8], התפתחות כלי דם קשתיים חדשים, גודש של כלי-הדם האפיסקלריים ודימום בלשכה הקדמית(hyphema) [1,10]. מחקרים בודדים דיווחו על בליטה קדמית של גלגל העין ((anterior staphyloma [6,11].
חדות הראיה לפני טיפול נעה לרוב בין 20/20 לבין 20/40, כאשר ב 8% מהמקרים חדות הראיה נעה בין 20/50 לבין 20/100
וב 6% מהמקרים חדות הראיה היא מעל 20/200. בסוף הטיפול חדות הראיה ב 45% מהמקרים נעה בין 20/20 ל 20/40, ב 14% מהמקרים חדות הראיה נעה בין 20/50 ל 20/100 וב 11% מהמקרים חדות הראיה נעה בין 20/200 לתחושת האור (light perception), כאשר בשליש מהמקרים נעקרה העין (enucleation)[1].
מבחינה היסטולוגית ב 55% ממקרי המלנומה מעורבים תאי כישור, ב 14% נמצאו תאים מסוג מעורב כאשר התאים הכישורים דומיננטיים, ב 24% נכחו תאי כישור ותאים אפיתליואידיים בצורה שווה, ב 5% נמצאו תאים מסוג מעורב כאשר התאים אפיתליואידיים דומיננטיים ורק ב 4% מהמקרים נמצאו תאים אפיתליואידיים [1]. Batioglu ו Gunalap [6] במחקרם על 41 מטופלי מלנומה ממאירה של הקשתית, דיווחו שב 77% מכלל המקרים נמצאו תאי כישור ממאירים, ב 17% נמצאו תאים ממאירים מסוג מעורב וב 2% תאים אפיתליואידיים ממאירים.
רוב הגידולים המלנוציטריים של הקשתית מתפתחים בד"כ משומות או מנמשים הנוטים להישאר יציבים ואינם מראים סימני ממאירות [8,12]. Territo וחב' [13] דיווחו על 175 מקרים שנחשדו כמלנומה ממאירה של הקשתית במהלך מעקב של 5 שנים, 3 מתוך 5 מקרים הוכחו כמלנומה ואילו 2 מתוך 5 מקרים הוכחו כתאי שומה, גם בסדרה גדולה של נבדקים שפורסמה ע"י Shiled`s וחב' [14] רק 50 מתוך 208 נגעים מלנוטיים בקשתית הוכחו כמלנומות.
במחקר קליני שפרסמו Jakobiec וחב' [7] על 189 שאתות שנמצאו בקשתית ובגוף העטרה, נמצא ש 13% מכלל השאתות היו שאתות ממאירות שסווגו ל 3 תתי- קבוצות: תאי כישור ממאירים, תאים מסוג מעורב המורכבים מתאי כישור ממאירים ומתאים אפיתליואידיים ממאירים וכן תאים אפיתליואידיים ממאירים ו 87% מהן היו שאתות שפירות שסווגו ל 6 תתי- קבוצות:Melanocytosis, Melanocytoma, Epithelioid Cell Nevus, Intrastromal Spindle Cell Nevus ,Spindle Cell Nevus with surface Plaque, Borderline Cell Nevus .
גרורות וגורמי סיכון
מס' מחקרים נעשו על מלנומה ממאירה של הקשתית כשהושם דגש על אפיונה הקליני וממצאיה ההיסטופתלוגים. Rones ו Zimmerman [4] דיווחו שב 1% מכלל המקרים נמצאו גרורות כעבור 5 שנים וב 6% מהמקרים נתגלו גרורות לאחר 15 שנה. לעומת זאת Shield`s וחב' [1] דיוחו ש 3% מהמקרים פתחו גרורות כעבור 5 שנים, 5% פיתחו גרורות כעבור 10 שנים ו 10% פיתחו גרורות כעבור 20 שנה.
המלנומה מתגלה בד"כ בגודל קטן יחסית לעומת רוב המלנומות של הדמית או של גוף העטרה [15,16]. Davidorf [17] הכיר בשוני הפרוגנוזה בין מלנומה ממאירה של הענביה הקדמית והאחורית והדגיש שמלנומה ממאירה של הקשתית מאובחנת כשגודלה הממוצע mm3 55 לעומת מלנומה כורואידאלית המתגלה כשגודלה הממוצע mm3 300. נתונים אלו מסבירים את השוני בפרוגנוזה שרק 3% מכלל הנבדקים סובלים מגרורות במלנומה של הקשתית, לעומת 15% מהנבדקים הסובלים מגרורות במלנומה כורואידאלית.
הפרוגנוזה של מטופלי מלנומה ממאירה של הקשתית טובה. שיעור התמותה נע בין 3-5% מכלל המטופלים [6,18] לעומת זאת במחקר שערכוMemmen and McLeancn [19] נמצא כי שיעור התמותה מגרורות היה 22%.
Rones and Zimmerman [4] דיוחו על 3 מתוך 67 מטופלי מלנומה ממאירה של הקשתית שנפטרו במהלך מחקרם ללא קשר לגידול ואילו Char וחב' [11] דיוחו על מטופל אחד מתוך 234 מטופלים שמת מהתפתחות הגרורות.
מס' מחקרים בודדים שנעשו על מס' מטופלים מצומצם ציינו שרוב מקרי המוות נתגלו במטופלים בעלי תאים אפיתליואידיים ממאירים [20].
הזמן בין הטיפול לבין גילוי הגרורות שונה בין מלנומה של הקשתית לבין מלנומה ממאירה של הענביה האחורית [12].
Kersten וחב' [20] ציינו שמרווח הזמן בין הטיפול לבין אבחון הגרורות היה כ 8.5 שנים ורק 3 מתוך 13 מטופלים נפטרו במהלך 5 השנים שלאחר הניתוח, לעומת זאת נמצאו גרורות לאחר זמן קצר יותר לאחר טיפול במלנומה של הענביה האחורית. מרווח הזמן בין עקירת העין לבין מיתת החולה הוא 3 שנים בממוצע [6].
גיל מבוגר והתפשטות הגידול מחוץ לעין הוגדרו כגורמי סיכון החשובים ביותר להתפשטות הגרורות מחלקה האחורי והקדמי של הענביה. עלית הלחץ התוך עיני [21], מעורבות הגידול בשורש הקשתית או בזוית העין הינם גורמי סיכון ייחודיים למלנומה ממאירה של הקשתית [1]. עלית הלחץ התוך עיני נמצאה בין 7% ל 30% ממטופלי מלנומה של הקשתית [2] ו 2% בקרב מקרי מלנומה כורואידלית [22] .
המכניזם של גלאוקומה מתחלקת ל 2 קב' עיקריות:
1. מטופלי מלנומה של הקשתית, שהלחץ התוך עיני גדל עקב תסנינים גידוליים ב Trabecular meshwork עם חסימה של תעלות היציאה ע"י תאי הגידול.
2. מטופלי מלנומה כורואידלית, שהלחץ התוך עיני נגרם ב 56% מהמטופלים עקב התפתחות כלי דם חדשים בקשתית, וב 34% מהמטופלים שונה מיקום העדשה או מבנה הקשתית, תהליך זה מוביל לסגירת זווית העין [22].
ישנם גורמי סיכון נוספים להתהוות הגרורות: חדות ראיה לא טובה, שינוי בגודל הגידול, מיקום הגידול בזוית העין וצורתו. בין כל הגורמים הקליניים המשפיעים על יצירת גרורות במלנומה ממאירה של הקשתית, הגורם אשר ניתן לעקוב אחריו ולטפל בו הינו הלחץ התוך עיני. הימנעות מהתפתחות גלאוקומה מומלצת, משום שסיבוך זה עלול להוביל לזריעת הגידול מחוץ לעין וליצירת גרורות.
גורם נוסף ליצירת גרורות הוא התערבות ניתוחית.Shield`s וחב' [1] דיווחו על 18 מקרים שעברו התערבות כירורגית, ל 10 מטופלים נלקחה ביופסיה, ל 7 נכרת הגידול ומטופל אחד נעקרה עינו. 3 מטופלים פיתחו גרורות לאחר לקיחת ביופסיה, כריתת הקשתית עם גוף העטרה ועקירת העין. לא ברור אם ההתערבות הניתוחית תרמה להתהוות הגרורות, אך כנראה שקיים קשר בין השניים.
ממחקרים בבע"חGrossniklaus וחב' [23] מצאו שלמרבית הגידולים מהלשכה הקדמית נמצאו גרורות בריאות ובקשרי- הלימפה הצווארים לעומתם לא נמצאו גרורות בקשרי- הלימפה הצווארים מגידולים מהלשכה האחורית. גרורות בריאות נמצאו בכלי הדם ומסביב לסמפונות (מדגם זה אינו זהה למע' גוף- האדם משום שהגרורה המתפתחת ממלנומה ממאירה של הענביה בגוף-האדם נמצאת בכבד). שיעור הגרורות מגידולים מהלשכה האחורית (89%) גבוה יותר מגרורות שהתפתחו מאזור הלשכה הקדמית (33%), ולכן סיכויי ההישרדות גבוהים יותר במלנומה ממאירה של הקשתית מאשר ממלנומה ממאירה של הענביה. Grossniklaus וחב' הציעו שישנם גורמים שונים בנוסף לגודל הגידול הקובעים את קצב שליחת הגרורות, כגון: שוני אנטומי, התפתחות כלי הדם של הגידול, השוני בסוג התאים הגידוליים ותגובה אימונית של המארח.
אבחון וטיפול
עם ההבנה הרחבה של התנהגותה הקלינית של מלנומה ממאירה של הקשתית הטיפול הפך להיות שמרני יותר. בעבר נהגו לטפל במלנומה ממאירה של הקשתית ע"י עקירת העין (enucleation), אולם מאז שהחלו להכיר בפרוגנוזה הטובה שיש למלנומה הגיעו למסקנה כי לכריתת הקשתית ((iridectomy יש מקום חשוב בטיפול [4].
בשנים האחרונות ישנה מגמה לטפל במלנומה במעקב תקופתי שמרני מאשר לנקוט טיפול אקטיבי. זאת משום שרק 4.6% מכלל הגידולים החשודים כממאירים מראים התפתחות קלינית לאורך 4.7 שנים לאחר האבחון ראשוני [13]. לעומת זאת כשהגידולים גדולים במיוחד ונמצאים בשורש הקשתית או בזוית, יש לנקוט בטיפול אקטיבי ולא במעקב, משום שקיים סיכוי גדול להתפתחות גלאוקומה וגרורות [1].
הגישה הקלינית הטובה ביותר לשאת החשודה כמלנומה ממאירה של הקשתית מתחילה בבדיקה קפדנית של הסגמנט הקדמי כל 6 חודשים. בדיקה זו כוללת את: הסקלרה, אפיסקלרה, קרנית, עדשה, קשתית, זווית העין (Gonioscopy) וצילום תקופתי של חלקה הקדמי של העין.
המיקום הקדמי של שאתות אלו מאפשר ביצוע ביופסיית מחט Fine Needle Aspiration Biopsy (FNAB) ביתר קלות, ואכן בחולים שישנו חשד למלנומה ממאירה של הקשתית, בדיקה זו יכולה להיות קלה, מהירה ומהימנה יותר מאמצעי אבחון אחרים, הגם שיש להביא בחשבון את המגבלה כאשר אנו מקבלים דגימת חלק זעיר מהשאת.
לאחרונה פורסמו מחקרים חדשים על בדיקת אולטרה – סאונד מדויקת יותר מהשיטות הקודמות הנקראת "אולטרא- סאונד ביו מיקרוסקופי" (UBM) Ultrasound BioMicrocopy [24]. אולטרה – סאונד קונבנציונאלי(B-scan) יכול לספק מידע על גודל ומיקום הגידול כאשר הרזולוציה שלו מוגבלת [25] לעומת זאת האולטרא- סאונד הביו מיקרוסקופי בעל MHZ 50 מספק רזולוציה גבוהה הנעה בין µm20 לµm60 הדומה במידה מסוימת לתמונה היסטופתלוגית של מיקרוסקופ אור [26], הוא בעל יכולת חדירה לרקמה בין 4-5 מ"מ ומוסיף מידע חשוב על גבולות הגידול ועל התפשטותו המקומית ללשכה האחורית, לזווית, לעדשה, לגוף העטרה וללובן העין [27-30].
במחקר שערכו Pavlin וחב' [24] נבדקו 45 מטופלים בחשד להתפתחות גידול בחלקה הקדמי של עיניהם באולטרא סאונד- קונבנציונלי (B-scan) ובמקביל באולטרא- סאונד ביו מיקרוסקופי . בבדיקת האולטרא-סאונד הקונבנציונאלי נתגלו אצל 17 מתוך 45 מטופלים לזיות יחסית גדולות בקשתית ובגוף העטרה, ואילו ציסטות ולזיות קטנות בקשתית ובגוף העטרה לא נתגלו. לעומת זאת האולטרא- סאונד ביו מיקרוסקופי חשף את כל 45 הלזיות שבקשתית ובגוף העטרה.
מאחר וקשה להגדיר קלינית את עומק חדירת הגידול לתוך הקשתית לפני הטיפול, חשוב לקשר בין ממצאי האולטרא- סאונד הביו מיקרוסקופי לבין הממצאים ההיסטופתולוגים [18,29]. הגדרת גבולות הגידול יכולה להתבצע רק על בסיס תאי עם מיקרוסקופ בעל רזולוציה גבוהה. לעומת זאת האולטרא- סאונד ביו מיקרוסקופי יכול להראות "בקירוב" את תחום הגידול ולאבחן את הגידולים בקשתית או בגוף העטרה [30] ולהבדיל בין גידולים לציסטות.
אולטרא- סאונד ביו מיקרוסקופי מוצע כבדיקה "לא חודרנית" לאספקטים אנטומים של גידול בחלקה הקדמי של העין. בעזרת טכניקה זו ניתן להעריך אפשרות לשליחת גרורות, לעקוב ולתכנן את הטיפול הרדיואקטיבי [29,31].
דורבן הלובן (Scleral spur) והממבראנה ע"ש דסמה מהווים נק' ציון כשמעריכים את מיקומו האנטומי של גידול בקשתית ביחס לזווית ולקרנית [32]. מידע זה חשוב כאשר שוקלים טיפול בלוחיות רדיואקטיביות (radioactive plaque therapy).
גודל הלוחיות ומיקומם ביחס לגידול ולשאר נק' הציון האנטומיות יכולים להיקבע בעזרת האולטרא- סאונד ביו מיקרוסקופי.
הלוחיות אמורות לספק קרינה אופטימאלית לגידול הממאיר ולהימנע מקרינה לא רצויה לרקמות נורמאליות בעין [32].
מטרת הטיפול הכירורגי בכריתה ניתוחית היא להוציא את השאת באופן מלא יחד עם שטחים בריאים. כשהגידול תחום בקשתית הוא מוסר בשלמותו מהקשתית וזאת בתנאי שאין זריעה או מערבות היקפית, שיטה זו נקראת scleroiridectomy [8,12]. כשהגידול בעל גבולות ברורים בשורש הקשתית או כאשר גוף העטרה מעורב מבוצע iridocyclectomy הכולל חיתוך רחב עם שוליים רחבים של הגידול בתוספת רקמה נורמאלית של הקשתית וגוף העטרה. בעקבות ניתוח זה עלולים להיגרם סיבוכים שונים כגון: איבוד הזגוגית, דיסלוקציה של העדשה, היפרדות רשתית, קטרקט גלאוקומה שניונית ונקב ברשתית [19].
כשקימת מעורבת של הלשכה האחורית מומלץ לבצע iridogoniocycletomy כשה trabeclur meshwork מוסר בשלמותו. כשהזריעה מפוזרת במקרים מסוימים נלקחת ביופסיה (FNAB) [33] על מנת לאשר את האבחנה או לשלול גידול שפיר הנקרא מלנוצטומה (melanocytoma) [34], במידה והאבחון הציטולוגי מראה על קיום מלנומה ממאירה נעקרת העין או במקרים נדירים מטפלים בלוחיות רדיואקטיביות plaque radiotherapy (I-125) [35].
Shield`s וחב' [40] הראו שב 93% ממקרי מלנומה ממאירה של הקשתית הגידול נסוג כאשר טיפלו בלוחות רדיואקטיביות (I-125) במנת שיא של 10600 cGy ו cGy 29300 במשך 96 שעות. ב 7% מהמקרים המלנומה הופיעה שנית בצורה מפוזרת, למרות מינונה הגבוה של הקרינה שניתנה דרך הקרנית. עיוות ובצקת הקרנית נתגלו כסיבוכי קרינה רק במקרה אחד.
ישנם תופעות לוואי אחרות כתוצאה מהקרינה כגון: התפתותם של כלי-דם חדשים בקשתית, הידוקים אחוריים וקטרקט. בקב' שסבלה מהתפתחות גרורות סיסטמיות ראשוניות שנתגלו בקשתית, נראתה רגרסיה של כל הגידולים ב 100% מהטופלים. תופעות הלוואי לא היו ידועות עקב הזמן הקצר יחסית של המעקב (כ 8 חודשים) אך 3 מתוך 4 מטופלים נפטרו מגרורות הגידול הממאיר הראשוני שמקורו ברקמה אחרת בגוף. לעומת זאת כל 14 המטופלים נשארו בריאים באופן סיסטמי ללא גרורות.
בשנים האחרונות הטיפול בלוחות רדיואקטיביות הופך להיות שיטה מומלצת לטיפול כשלא ניתן לבצע כריתה ניתוחית וכאשר ישנם גרורות ראשוניות בקשתית יחד עם זאת מופיעות תופעות לוואי הקשורות לזיוות בקשתית.
ביבליוגרפיה
1. Shields CL, Shileds JA. Iris Melanoma: Risk Facts for Metastasis in 169 Consecutive Patients. Ophthalmology 2001; 108: 172-178.
2. Arensten JJ, Green WR. Melanoma of the iris: Report of the 72 Cases Treated Surgically. Ophthalmic surg 1975;6: 23.
3. Jensen OA. Malignant melanomas of the human uvea. Recent follow-up of cases in Denmark, 1943- 1952, Acta Ophthalmol ( Copenh ) 1970;48:1113-28.
4. Rones B, Zimmerman LE. The prognosis of the primary tumors of the iris treated by iridectomy. Arch Ophthalmol 1958;60: 193-205.
5. Raivio I. Uveal melanoma in Finland. An epidemiological, clinical, histological and prognostic study. Acta Ophthalmol Scand Suppl 1977;133: 1-64.
6 Batioglu F, Gunalap I. Malignant Melanomas of the Iris. Jpn J Ophthalmol 1998;42: 281-285.
7. Jakobiec FA, Silbert G. Are Most Iris Melanomas Really Nevi ? A Clinic pathologic Study of 189 Lesions. Arch Ophthalmol 1981;99: 2117.
8. Shields JA, Shields CL. Intraocular Tumors: A Text and Atlas. Philadelphia: WB Saunders. 1992; 61-84.
9. Rootman J, Gallanher RP. Color As a Risk Factor in Iris Melanoma. Am J Ophthalmol 1984;98: 558.
10. Shammas HJ. Iris melanoma. In:Fraunfelder FT. Roy FH. Eds. Current ocular therapy. Philadelphia: WB Saunders, 1990:558-9.
11. Char DH, Crawford JB, Kroll S. Iris melanomas. Diagnostic problems. Ophthalmology 1996;103: 1251-5.
12. Shields JA, Shields CL. Atlas of Intraocular Tumors. Philadelphia: Lippincott Williams & Wilkins, 1999; 17-42.
13. Territo C, Shields CL, Shields JA, Augsburger JJ, Schroeder RP. Natural course of melanocytic tumors of the iris. Ophthalmology 1988;95: 1251-5.
14. Shields JA, Sanborn GE, Augsburger JJ. The Differential Diagnosis of Malignant Melanoma of the Iris: A Clinical Study of 200 patients. Ophthalmology 1983;90: 716.
15. Diener-West M, Hawkins BS, Markowitz JA, Schachat AP. A review of mortality from chorodial melanoma. II. A meta-analysis of 5 year mortality rates following enucleation, 1966 through 1988. Arch Ophthalmol 1992;110: 245-50. 16. Shields CL, Shields JA, Kiratli H, et al. Risk factors for growth and metastasis of small chorodial melanocytic lesions. Ophthalmology 1995;102: 1351-61.
17. Davidorf FH. The melanoma controversy. A comparison of chorodial, cutaneous, and iris melanoumas. Surv Ophtalmology 1981;25: 1351-61
18. Geisse LJ, Robertson DM. Iris melanomas. Am J Ophthalmol 1985;99 :638-48.
19. Memmen JE, McLean IW . The long-term outcome of patients undergoing iridocyclectomy. Ophthalmology 1990;97: 429-32.
20. Kersten RC. Tse DT, Anderson R. Iris melanoma. Nevus or malignancy ? Surv Ophthalmol 1985;29: 423-33.
21. Kremer I, Svetliza E. Is iris melanoma really a nevus. Harefuah 1989 Mar 1;116 (5): 252-4
22. Shields CL, Shields JA, Shields MB. Prevalence and mechanisms of secondary intraocular pressure elevation in eyes with intraocular tumors. Ophthalmology 1987;94: 839-46.
23. Grossniklaus HE, Wilson MW, Barron BC, Lynn ML. Anterior vs posterior intraocular melanoma. Metastasi differences in a murine model. Arch Ophthalmol 1996;114: 1116-20.
24. Pelvin CJ, McWhae JA. Ultrasound Biomicroscopy of Anterior Segment Tumors. Ophthalmology 1992;99: 1220-1228.
25. Shields JA, Shields CL. Diagnosis and treatment of uveal melanoma. Semin Oncol.1996;23: 763- 767 .
26. Flavio A. Marigo, MD. Iris and Ciliary Body Melanomas. Ultrasound Biomicroscopy With Histopathologic Correlation. Arch Ophthalmol. 2000;118 :1515-1521.
27. Pavlin CJ, Foster FS. Ultrasound Biomicroscopy of the eye. New York. NY: Springer-Verlag NY Inc;1995.
28. Maberly DA, Pavlin CJ. Ultrasound biomicroscopic imaging of the anterior aspect of peripheral chorodial melanomas. Am J Ophthalmol. 1997;123: 506-514.
29. Pavlin CJ, McWhae JA. Ultrasound biomicroscopy of anterior segment tumors. Ophthalmology. 1992;99: 1220-1228.
30. Marigo FA, Esaki K. Anterior segment implantation cysts: ultrasound biomicroscopy and histopathologic correlation. Arch Ophthalmol. 1998;116: 1569-1578.
31. Ursea R, Coleman J. Correlation of High-frequency Ultrasound Backscatter with Tumor Microstructure in Iris Melanoma. Ophthalmology 1998;105: 906-912.
32. Pavlin CJ, Harasiewicz K. Ultrasound biomicroscopy of anterior segment structures in normal and glaucomatous eyes. Am J Ophthalmol. 1992;113: 381-389.
33. Shields JA, Shields CL, Ehya H, et al. Fine needle aspiration biopsy of suspect intraocular tumors. The 1992 Urwick Lecture. Ophthalmology 1993;100: 1677-84.
34. Fineman M, Eagle RC Jr, Shields JA, et al. Melanocytomalytic glaucoma in eyes with necrotic iris melanocytoma. Ophthalmology 1998;105 :492-6.
35. Shields CL, Shields JA. De Potter P. et al. Treatment of non-resectable malignant iris tumors with custom designed plaque radiotherapy. Br J Ophthalmol 1995;79: 306-12